L’identification des mécanismes de dégénération et de protection en utilisant la résistance des neurones moteurs de l’œil comme modèle
Eva Hedlund, professeur de neurobiologie associée dans le département de Neuroscience à l’Institut Karolinska en Suède et Stefania Corti Professeur assistant en Neurologie, dans le département des sciences neurologiques de l’université de Milan en Italie, collaborent sur un projet de recherche sélectionné en 2012 par la Fondation Thierry Latran dont les premiers résultats viennent d’être publiés dans Neuroscience.
Eva Hedlund présente pour la Fondation, les travaux menés dans son laboratoire et sa collaboration avec Stefania Corti.
Les maladies neurodégénératives sont caractérisées par la perte sélective de populations neuronales spécifiques correspondant à des tableaux cliniques distincts, même lorsque les protéines pathogènes sont exprimées de façon ubiquitaire.
La Sclérose Latérale Amyotrophique est définie par la perte des neurones somatiques qui innervent les muscles striés (mobilisés pour les mouvements volontaires) des bras, des jambes, du tronc et de la figure, aboutissant à une fonte musculaire. Cependant l’ensemble de ces neurones moteurs ne sont pas vulnérables de manière égale. Certains groupes sont épargnés, comme ceux du noyau oculomoteur, situé dans le tronc cérébral (partie du système nerveux central servant de relai entre les structures du cerveau et la moelle épinière), commandant les mouvements de l’œil (figure 1) et ceux du noyau d’Onuf, situé au bas de la moelle épinière, commandant les muscles périnéaux.
Les raisons de cette différence de vulnérabilité parmi les neurones de moteur demeurent inconnues.
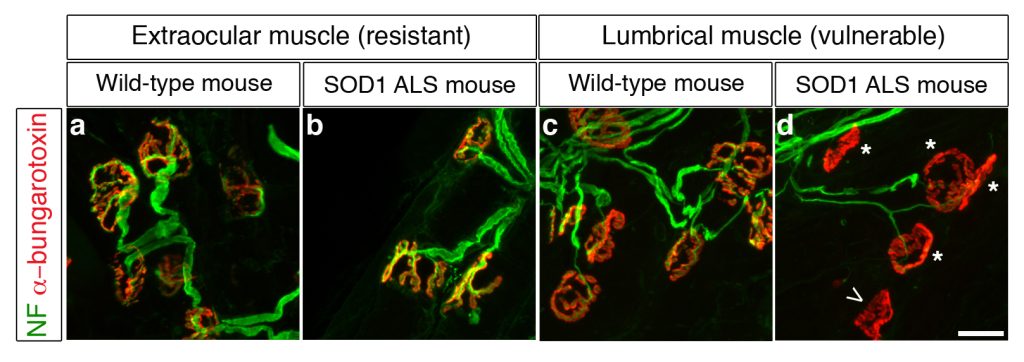
Figure 1. Comparaison des jonctions neuromusculaires dans des muscles oculomoteurs et des doigts sur un modèle de souris normales et atteintes de SLA. (Fluorescence verte pour les nerfs – rouge pour les muscles) A leur extrémité distale les motoneurones communiquent directement avec le muscle squelettique ; ces connexions spécialisées se nomment jonctions neuromusculaires (JcNM). Leur analyse à 112 jours montre que : Les JcNM sont bien innervés, intactes et comparables aux souris saines pour les muscles oculomoteurs (a, b), alors que pour les petits muscles des doigts, les JcNM sont anormales (d) comparées au souris saines (c). Les anomalies retrouvées sont : une jonction vide (pointe de flèche, d) ou partiellement innervée (* dans d).
Les expériences basées sur les modèles transgéniques de souris et sur des motoneurones humains dérivés de cellules de peau (fibroblastes) de patients indiquent que des facteurs dans les neurones moteurs sont importants pour le déclenchement du processus dégénératif.
Ainsi, une analyse des propriétés intrinsèques des neurones moteurs montrant la susceptibilité différentielle à la maladie pourrait indiquer pourquoi certains neurones de moteur sont résistants à la dégénération et permettre la mise au point de traitements.
Pour élucider les mécanismes moléculaires des différences de vulnérabilité des motoneurones, le laboratoire isole les motoneurones résistants et vulnérables chez les souris saines et malades (figure 2)
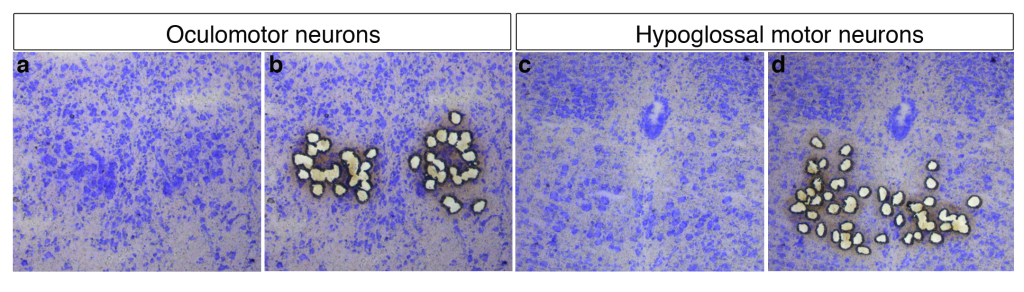
Figure 2. Isolement des neurones résistants oculomoteurs resistant (a, b) et des neurones vulnérables du noyau hypoglosse qui contrôle les muscles de la langue (c, d) par microdissection laser. La microdissection laser est une technologie relativement récente qui permet d’isoler, sous contrôle morphologique, des cellules d’intérêt à partir d’une coupe de tissu, au moyen d’un faisceau laser. Il devient ainsi possible de s’affranchir de l’hétérogénéité cellulaire d’un tissu et d’extraire les biomolécules contenues dans un seul type cellulaire pour mener des études de génomique (extraction et analyse de l’ADN ou de l’ARN) ou de protéomique (extraction et analyse de protéines) à l’échelle de la cellule.
Le laboratoire identifie ensuite la totalité des ARN messagers transcrits à un moment donné : l’ARN messager est une copie d’une région de l’ADN correspondant à un ou plusieurs gènes codant pour des protéines. Cette opération de copie appelée transcription se passe dans le noyau de la cellule, l’ARN messager va ensuite passer du noyau de la cellule dans le cytoplasme, lieu de la synthèse des protéines. L’ensemble des ARN messagers (mARN) issu de la transcription du génome est appelé transcriptome. Pour mesurer simultanément la concentration d’un grand nombre d’ARN messagers de types différents, on utilise les techniques dites de séquençage à haut débit qui permettent de détecter tous les ARN dont ceux de petite taille mais aussi d’analyser les transcrits sans sélection préalables de gènes connus. La caractérisation et la quantification du transcriptome dans un tissu donné et dans des conditions données permettent d’identifier les gènes actifs, de déterminer les mécanismes de régulation d’expression des gènes et de définir les réseaux d’expression des gènes.
Cela permet d’étudier dans les modèles ALS, comment les cellules résistantes modulent leur transcriptome, c’est-à-dire quels sont les gènes qui sont activés, en comparant avec le transcriptome des cellules vulnérables. Les différences retrouvées permettent d’identifier des ARNm transcrits potentiellement impliqués dans les mécanismes de vulnérabilité ou de résistance.
Ces candidats sont testés pour leur pertinence dans la SLA sur des tissus humains prélevés sur des malades décédés. L’étape suivante est l’analyse in vitro sur des cellules humaines issues de cellules souches ( figure 3) ainsi qu’in vivo sur des modèles murins de la capacité de ces ARNm candidats à moduler la survie des neurones moteurs ( résistant et vulnérable).
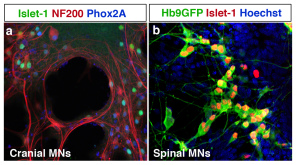
Figure 3 Motoneurones de cerveau incluant des neurones occulomoteur résistants (a) et de la moelle épinières (b) créés à partir de cellules souches pluripotentes.
Une collaboration étroite est établie avec le laboratoire du prof. Stefania Corti à l’université de Milano pour screener des gènes candidats in vitro et in vivo. Le but à long terme est d’identifier des gènes cibles qui pourraient être régulés pour protéger les motoneurones vulnérables encore intacts chez les malades. La découverte de certaines propriétés qui rendent les neurones oculomoteurs résistants permettrait de les transférer aux neurones vulnérables afin de les protéger
À l’aide d’une analyse de l’expression génique des motoneurones ayant une vulnérabilité différente, les deux équipes ont précédemment identifiés de nombreux gènes qui ont une expression restreinte aux neurones oculomoteurs et l’absence de gènes dans les neurones touchés. Eva Hedlund a démontré que l’expression du gène spécifique aux neurones oculomoteurs de la parvalbumine protège ces motoneurones de la dégénérescence. De plus, ses études montrent que d’autres facteurs de transcriptions spécifiques comme la Guanine Déaminase ou le facteur de croissance insuline-like II qui peuvent rendre résistants des motoneurones vulnérables à la dégénérescence. L’objectif du projet est de mieux caractériser les propriétés de protection possibles de ces molécules spécifiques afin de développer une nouvelle approche thérapeutique pour la SLA. À l’aide de la thérapie génique, il sera étudié si l’introduction des gènes spécifiques des neurones oculomoteurs « protecteurs » dans les motoneurones vulnérables au niveau de la colonne vertébrale peuvent induire une résistance à la dégénérescence. Le projet combine des approches in vitro et in vivo, pour augmenter la possibilité de définir des gènes cibles efficaces en thérapeutique.