 Suite de notre compte rendu du 22ème congrès annuel international de l’association anglaise MNDA (Motor Neuron Disease Association) qui s’est tenu à Sydney en Australie fin 2011 regroupant plus de 600 chercheurs venus de 33 pays.
Suite de notre compte rendu du 22ème congrès annuel international de l’association anglaise MNDA (Motor Neuron Disease Association) qui s’est tenu à Sydney en Australie fin 2011 regroupant plus de 600 chercheurs venus de 33 pays.
Voici en deuxième lieu une synthèse réalisée par le Dr Pierre-François Pradat (Hôpital de la Pitié-Salpétrière, Paris) et le Dr Valérie de Broglie (Fondation Latran, Paris) sur notre deuxième thématique phare : les essais thérapeutiques.
Anticorps anti protéine Nogo-A (GSK1223249)
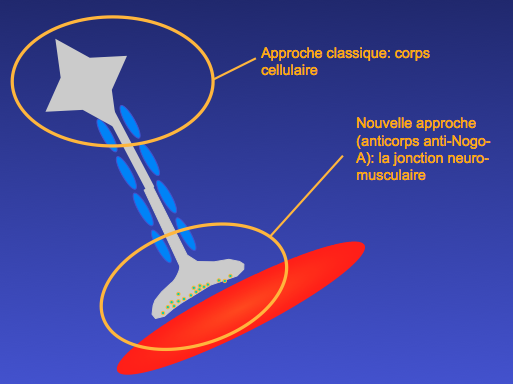 Légende : Les anticorps anti NogoA sont une nouvelle approche de neuroprotection visant la jonction neuromusculaire (Pradat et coll., Paris, 2001). Les approches classiques de neuroprotection ont comme rationnel de protéger les corps cellulaires des motoneurones, qu’elles ciblent des mécanismes intrinseques comme l’apoptose, au des mécanismes extrinsèques liés à l’environnement, comme l’inflammation. Toutefois ces approches ont montré leurs limites par l’échec de nombreux essais thérapeutiques visant à lutter contre ces mécanismes. Une nouvelle approche vise cette fois à protéger la jonction neuromusculaire, notamment en ciblant des anomalies musculaires comme l’augmentation de la protéine Nogo-A.
Légende : Les anticorps anti NogoA sont une nouvelle approche de neuroprotection visant la jonction neuromusculaire (Pradat et coll., Paris, 2001). Les approches classiques de neuroprotection ont comme rationnel de protéger les corps cellulaires des motoneurones, qu’elles ciblent des mécanismes intrinseques comme l’apoptose, au des mécanismes extrinsèques liés à l’environnement, comme l’inflammation. Toutefois ces approches ont montré leurs limites par l’échec de nombreux essais thérapeutiques visant à lutter contre ces mécanismes. Une nouvelle approche vise cette fois à protéger la jonction neuromusculaire, notamment en ciblant des anomalies musculaires comme l’augmentation de la protéine Nogo-A.
Le Dr Pierre-François Pradat, de la Pitié Salpêtrière, a présenté des premiers résultats cliniques obtenus avec ce médicament, développé par le laboratoire pharmaceutique GlaxoSmithKline, médicament délivré par voie intraveineuse. L’augmentation dans le muscle des patients SLA de la protéine Nogo-A a été démontrée par des travaux réalisés à la Pitié-Salpétrière en collaboration avec l’équipe de Jean-Philippe Loeffler (Strasbourg). Cette protéine ayant comme fonction connue d’empêcher la repousse des axones dans le système nerveux central (Dupuis et col, Neurobiol Dis, 2002 ; Pradat et al, Ann Neurol 2007), le développement d’une thérapeutique bloquant cet excès de protéine pourrait permettre de protéger au niveau de la jonction neuromusculaire la terminaison des nerfs moteurs et de favoriser la repousse des axones. L’étude de phase I où l’antiNogoA a été administré à des malades visait à déterminer la sécurité de son utilisation et sa tolérance chez des patients SLA.
Il s’agit d’un essai international, coordonné par le Pr Vincent Meininger (Pitié-Salpêtrière, Paris). En France le centre d’investigation clinique (CICM) de l’Institut du Cerveau et de la Moelle à la Pitié Salpêtrière a participé à l’étude. L’étude a consisté à tester par voie intraveineuse des doses progressivement croissantes d’anticorps. Il n’a pas été pas observé d’effets secondaires importants même aux doses les plus élevées. Une crainte était que les patients développent des anticorps dirigés contre le médicament, puisqu’il s’agit d’une protéine, mais un seul patient a développé de tels anticorps et à des niveaux négligeables. De plus, les patients qui ont reçus les doses les plus élevées semblent présenter une évolution plus lente que ceux qui ont reçus un placebo, mais bien sûr il n’est pas possible de conclure en termes d’efficacité à ce stade, cette étude comportant un nombre de patients trop faible et une durée d’évaluation trop courte. Par ailleurs, il s’agit de données préliminaires, l’ensemble des données de l’essai n’étant pas disponibles. Un caractère innovant de ce travail est de pouvoir avoir accès directement à l’effet de l’anticorps, sur sa cible, la protéine Nogo-A n’étant pas située dans le système nerveux central mais au niveau périphérique, accessible par voie de biopsie musculaire. Certains patients ont ainsi pu bénéficier d’une biopsie musculaire avant et après traitement, ce qui permettra de mesurer la fixation desanticorps anti-Nogo-A sur leur cible présente à la surface des fibres musculaires et de déterminer si le traitement améliore des paramètres biologiques traduisant l’état d’innervation du muscle, notamment en mesurant les modifications d’expression d’un très grand nombre de gène. Ce type de démarche permettra d’optimiser au mieux l’essai international qui devrait être conduit en 2012 et aura pour but d’évaluer l’efficacité du traitement.
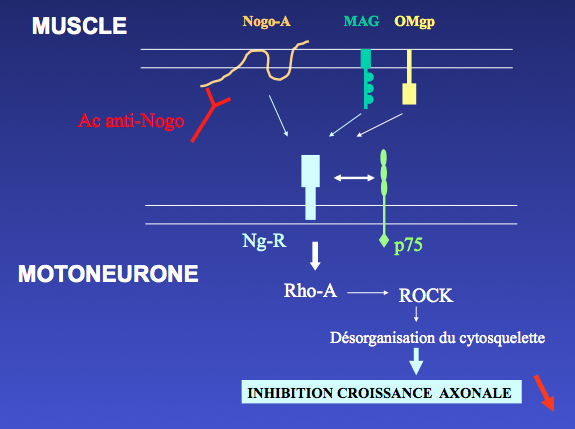 Légende : Bloquer l’effet de la protéine Nogo-A (Pradat et coll, Paris, 2001). La protéine Nogo-A est située sur la membrane des cellules musculaires. C’est une protéine transmembranaire, c’est-à-dire qu’une partie de la protéine est située à l’extérieur de la fibre musculaire. L’anticorps vient neutraliser cette partie de la protéine qui interagit avec le motoneurone. L’effet recherché est de bloquer la cascade de réactions qui aboutissent à empêcher la croissance des axones.
Légende : Bloquer l’effet de la protéine Nogo-A (Pradat et coll, Paris, 2001). La protéine Nogo-A est située sur la membrane des cellules musculaires. C’est une protéine transmembranaire, c’est-à-dire qu’une partie de la protéine est située à l’extérieur de la fibre musculaire. L’anticorps vient neutraliser cette partie de la protéine qui interagit avec le motoneurone. L’effet recherché est de bloquer la cascade de réactions qui aboutissent à empêcher la croissance des axones.
Carbonate de lithium
Un essai thérapeutique a été présenté par le Pr Leonard Van den Berg (Utrecht, Hollande). Dans cet essai, les résultats ne montrent pas d’efficacité majeure dans le groupe traité par rapport au placebo. Il n’y a pas eu non plus d’augmentation d’effets secondaires dans le groupe traité. On attend pour conclure les résultats d’un essai anglais sur un grand nombre de patients qui ne sera terminé qu’au printemps 2012. Seul cet essai anglais conçu pour détecter un effet minime donnera une réponde définitive sur l’intérêt de prescrire du Lithium dans la SLA.
NP001
Le NP001 est un médicament développé par la société Neuraltus Pharmaceuticals (Palo Alto, Californie) spécialisée dans le développement de médicaments pour les maladies dont les besoins thérapeutiques sont majeurs comme pour la SLA. Le NP001 est une petite molécule administrée par voie intraveineuse qui agit au niveau de la régulation de l’activation pathologique des macrophages. Cette activation est possiblement non pas la cause du déclenchement de la maladie mais un facteur impliqué dans son aggravation. Robert Miller (Forbes Norris MDA/ ALS Research Center à San Francisco), qui est l’investigateur principal de l’étude, et un spécialiste de renommée mondiale, a présenté l’état d’avancement du développement du NP001. Le NP001 est en phase II, après les résultats positifs obtenus en phase I (résultats de tolérance comme pour tous les essais de phase I). L’essai de phase II est un essai contre placebo, d’une dose forte et d’une dose faible, il comporte donc 3 bras. 105 patients doivent être recrutés pour mesurer la tolérance et l’efficacité du traitement. L’efficacité sera jugée tant sur des paramètres cliniques que biologiques, un impact sur des marqueurs sanguins d’activation des macrophages ayant été trouvé en phase I.
Cellules souches
La société Neuralstem (Rockville, MD près de Washington), société de biotechnologie qui dispose d’une technologie brevetée de cellules souches neurales humaines, développe des traitements pour les maladies du Système Nerveux Central. Elle est la 1ère compagnie au monde à avoir obtenu l’accord de la FDA (Food Drug Administration, Etats-Unis) pour un essai de phase I, visant à évaluer la tolérance et la sécurité (et non l’efficacité). de la procédure chirurgicale associée à l’immunosuppression. Les résultats des 12 patients ont été présentés. Les cellules souches neurales ont été transplantées directement dans la partie inférieure de la moelle épinière (niveau lombaire) soit d’un seul côté, soit de façon bilatérale (5 à 10 injections). Les auteurs concluent au succès de cette étude, les procédures chirurgicales n’ayant pas entraînées de complications majeures, la tolérance des cellules souches étant satisfaisante pendant le suivi de 4 à 12 mois. Ils ne notent pas d’aggravation de la maladie due au traitement, et constatent en émettant les réserves nécessaires compte tenu du fait que cet essai n’est pas un essai d’efficacité, qu’un patient semble être amélioré et que quelques autres auraient un ralentissement de la progression. Sur la base de ces résultats, Neuralstem a obtenu l’autorisation de mener une étude complémentaire avec une transplantation de cellules souches au niveau de la moelle cervicale afin d’évaluer les effets au niveau de la fonction respiratoire.

2 commentaires, RSS