La Fondation Thierry Latran a sélectionné en 2013 un projet innovant portant sur la restauration de la barrière hémato encéphalique dans la SLA.
Les résultats viennent d’être publiés dans Acta Neuropathologica journal, revue scientifique de haut niveau, attestant de la qualité scientifique du projet et de l’intérêt des résultats trouvés.
Sebastian Lewandowski qui est chercheur post doc dans le laboratoire sur Professeur Ulf Eriksson, responsable du département de biologie vasculaire au Karolinska Institutet en Suède, nous présente les résultats de ce projet.
Résumé du projet
Les facteurs menant au développement de la neuro dégénération dans la SLA sporadique (sSLA) sont mal compris. Il a été démontré précédemment que des dommages traumatiques cérébraux sont associés au risque accru de développement d’une SLA (référence 1), ils sont également mis en cause dans les taux accrus de mortalité observés chez les militaires en service (références 2.3), les joueurs professionnels de football (référence 4) et la population générale (référence 1). Une hypothèse est que le dysfonctionnement de la barrière hémato méningée suite à un traumatisme cérébral peut être une des causes de SLA. Cependant, les mécanismes cellulaires et moléculaires reliant traumatismes et développement ultérieur de maladies neuro dégénératives demeurent en grande partie inconnus.
Nous avons précédemment prouvé que l’activation de la voie du Facteur de croissance C dérivé des plaquettes (PDGFC) se produit en réponse aux dommages cérébraux causés par un accident ischémique (référence 5), des crises d’épilepsie (référence 6) et des chocs (référence 7), avec comme conséquence une augmentation du taux de cette protéine dans le Liquide Céphalo Rachidien (LCR) des patients (référence 7). Dans ces pathologies la PDGFC est activée par l’activateur tissulaire du Plasminogène (PLAT) ce qui conduit à l’accumulation de PDGFC clivé et au dysfonctionnement de la barrière hémato méningée (référence 5.6.7.8), ce qui suggère que cela pourrait également se produire dans la SLA.
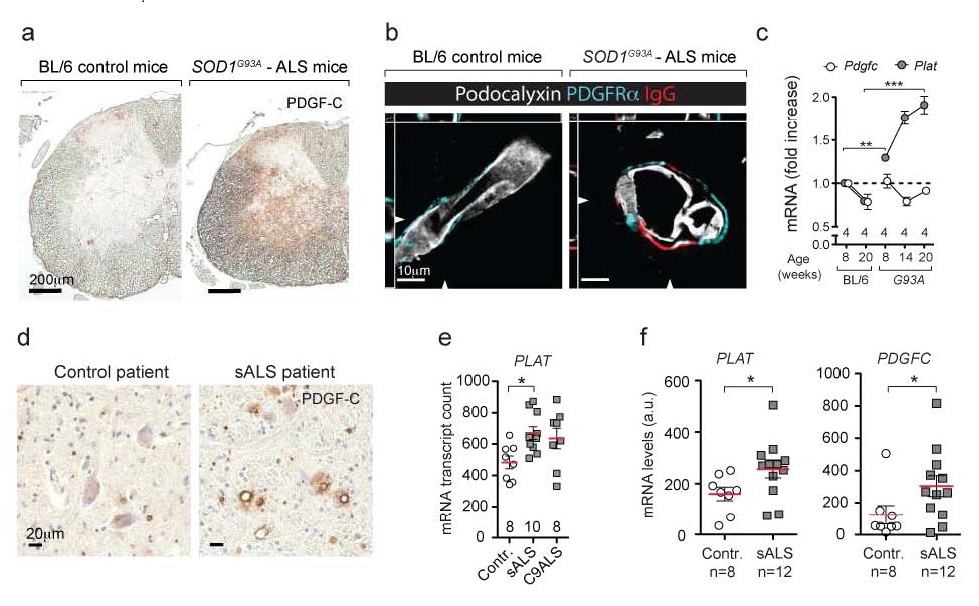
Notre travail récemment publié prouve qu’il y a une augmentation d’activité de la voie PDGFC dans les cordons médullaires du modèle de souris SLA SOD1G93A et dans les tissus des patients atteints de SLA sporadiques (référence 9) (Figure 1).
Figure 1. La voie de signalisation de la PDGFC est activée avant l’apparition des symptômes.
a, Accumulation de PDGFC dans le cordon médullaire du modèle de souris SLA SOD1G93A détectée par immunohistochimie. b, Des vaisseaux sanguins du cordon médullaire (blanc) montrent une augmentation de la perméabilité aux Immunoglobulines de type G (rouge), ces vaisseaux expriment le récepteur de la protéine PDGFC (turquoise). d, L’accumulation de PDGFC dans le bulbe rachidien de malades sSLA détectée par immunohistochimie (n = 4). e, l’expression d’ARN messager (mRNA) de PLAT est augmentée dans le cortex frontal des malades sSLA. f Augmentation de l’expression d’ARN messager (mRNA) de PDGFC et PLAT dans des motoneurones (par capture laser) de malades sSLA (n = 12) et contrôles (n = 8)
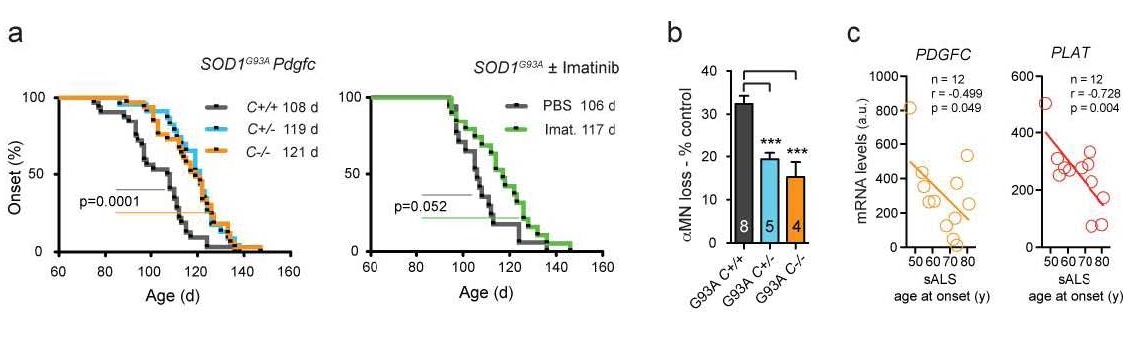
Nous avons réduit l’activation du PDGFC chez des souris SOD1G93A par deux méthodes : ablation du gène codant pour la PDGFC et utilisation de l’Imatinib qui est un inhibiteur pharmacologique. Les deux approches ont permis la restauration des propriétés sang – barrière hémato méningée (référence 9) et un retard du début des symptômes (Figure 2).
Figure 2. La diminution de l’activité PDGFC retarde l’apparition de la SLA. a, La déplétion du gène Pdgfc partielle (C+/-, ligne bleue) ou totale (C-/-, ligne orange) dans une souris SOD1G93A ALS retarde de 11 et 13 jours respectivement l’apparition des symptômes comparé aux souris contrôles (C+/+, ligne grise). Nous avons observés des effets similaires (14 jours de retard) avec les souris traitées par imatinib (ligne verte) a. b, Environ la moitié des motoneurones sont épargnés dans la moelle épinière des souris déficientes (C+/-, bleu), (C-/-, orange) au moment de l’apparition des symptômes comparé aux contrôles. (C+/+, gris). c, Une corrélation significative est retrouvée entre l’âge d’apparition de la maladie et l’expression neuronale des gènes chez les malades sSLA dont l’expression neuronale des gènes est diminuée.
En résumé, nos observations prouvent que l’activation de la protéine PDGFC se produit avant le début des symptômes dans les modèles génétiques de souris SLA et est présente dans les patients atteints de SLA sporadique. La corrélation entre l’activité de PDGFC et l’âge du début de la SLA peut fournir un mécanisme plausible expliquant pourquoi les dommages traumatiques qui mènent également à l’activation de PDGFC (référence 1) ont un risque plus fort pour développer une sSLA. Puisque l’imatinib peut également affecter d’autres voies de signalisation, notre groupe travaille actuellement pour développer une stratégie de traitement spécifique à la protéine PDGFC en utilisant les anticorps monoclonaux. Cette approche pourrait être développée en thérapie au début de la maladie.
References (Pub Med ID numbers): (1) – 25059395; (2) – 14504315; (3) – 15642900; (4) – 22955124; (5) – 18568034; (6) – 26273685; (7) – 26500491; (8) – 23437178; (9) –